 あらゆる生命体にとって、遺伝情報を次の世代に伝えることは生命の存続に不可欠です。遺伝情報物質であるDNAが、どのようなしくみで情報を記録し、それがどのような酵素群によって複製されるかについては、James Watson、Francis Crickを源流に、Arthur Kornberg、岡崎令治などの偉大な先人達による長い研究の歴史があります。それでもなお、この分野にはたくさんの本質的な謎が残されています。我々はいまだに真核生物染色体を複製する装置(レプリソーム)の完全な姿を知りません。また、DNA複製がどのような機構を介して染色体の分配と連携しているか(実際連携しています!)、正確に理解していません。DNAが損傷を受けた際にはさまざまな損傷応答機構がはたらきますが、それらの制御機構や動作機構にはたくさんの謎が残っています。さらに言えば、真核生物の染色体は多種多様なタンパク質によって折りたたまれ、巻き取られ、高次に組織化されていますが、それらとDNA複製の関わりについては、分かっていることより分かっていないことの方がはるかに多いのです。
あらゆる生命体にとって、遺伝情報を次の世代に伝えることは生命の存続に不可欠です。遺伝情報物質であるDNAが、どのようなしくみで情報を記録し、それがどのような酵素群によって複製されるかについては、James Watson、Francis Crickを源流に、Arthur Kornberg、岡崎令治などの偉大な先人達による長い研究の歴史があります。それでもなお、この分野にはたくさんの本質的な謎が残されています。我々はいまだに真核生物染色体を複製する装置(レプリソーム)の完全な姿を知りません。また、DNA複製がどのような機構を介して染色体の分配と連携しているか(実際連携しています!)、正確に理解していません。DNAが損傷を受けた際にはさまざまな損傷応答機構がはたらきますが、それらの制御機構や動作機構にはたくさんの謎が残っています。さらに言えば、真核生物の染色体は多種多様なタンパク質によって折りたたまれ、巻き取られ、高次に組織化されていますが、それらとDNA複製の関わりについては、分かっていることより分かっていないことの方がはるかに多いのです。
私たちの研究室では、遺伝情報の複製と修復に焦点をあて、「まだ誰も答えを知らないけれど、本質的に大事な謎」を解き明かすべく研究を行っています。理学部における基礎研究の一つのゴールは、人類の知的好奇心を満たし、端的に言えば教科書を書き足し、書き換える事です。一方で、遺伝情報の複製、維持機構は、がん、白血病、さまざまな染色体異常、ハンチントン病に代表されるリピート病、Ataxia telangiectasiaやNijmegen breakage syndrome, Cornelia de Lange syndrome等多数の遺伝性難病などに大きく関わっています。また別な面では、ゲノム編集を含む遺伝子組み換え技術のおおよそは、遺伝情報複製、修復機構の技術応用と言えます。遺伝情報維持機構を理解することは、これらの病気の原因や、さまざまな遺伝子工学技術を正しく理解し、その先の未来につなげるためにも重要な役割を果たします。
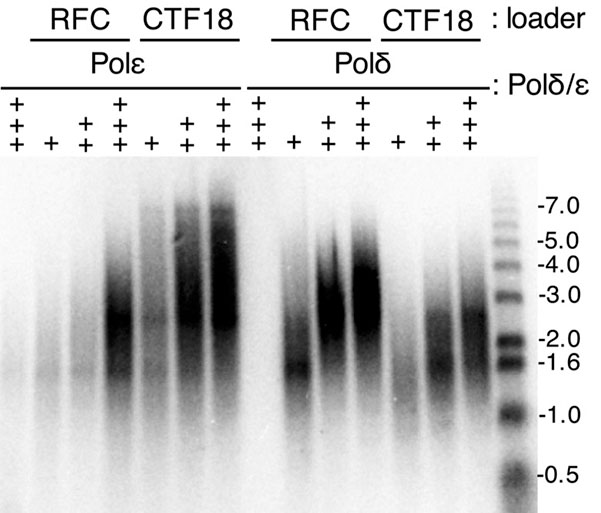 真核生物の染色体複製は多数の酵素群が協調的に働くことで達成されます。DNA二重鎖はCdc45–MCM–GINS(CMG)複合体によって開裂され、生じた一本鎖DNAを鋳型としてDNA合成酵素が働きます。真核生物では、連続合成されるリーディング鎖ではPolymerase (Pol) εが、不連続合成されるラギング鎖ではPol αとδが主に働くことが分かってきました。DNA合成酵素は単独で十分に機能する事ができず、足場となる“複製クランプ”を必要とします。真核生物の複製クランプはPCNA三量体で、さらにPCNAをDNAに乗せるためにはクランプローダーと呼ばれる複合体が必要です。面白いことにクランプローダーにも種類があり、RFC、Ctf18–RFC、Elg1-RFCなどがPCNA関連ローダーとして知られています。(RFCは当研究室の釣本が初めて精製、同定した因子です)当研究室ではクランプとクランプローダー、CMGを中心にDNA複製の研究を進めており、Ctf18–RFCがリーディング鎖ポリメラーゼであるPol εと協調して機能する事などを発見しています。
真核生物の染色体複製は多数の酵素群が協調的に働くことで達成されます。DNA二重鎖はCdc45–MCM–GINS(CMG)複合体によって開裂され、生じた一本鎖DNAを鋳型としてDNA合成酵素が働きます。真核生物では、連続合成されるリーディング鎖ではPolymerase (Pol) εが、不連続合成されるラギング鎖ではPol αとδが主に働くことが分かってきました。DNA合成酵素は単独で十分に機能する事ができず、足場となる“複製クランプ”を必要とします。真核生物の複製クランプはPCNA三量体で、さらにPCNAをDNAに乗せるためにはクランプローダーと呼ばれる複合体が必要です。面白いことにクランプローダーにも種類があり、RFC、Ctf18–RFC、Elg1-RFCなどがPCNA関連ローダーとして知られています。(RFCは当研究室の釣本が初めて精製、同定した因子です)当研究室ではクランプとクランプローダー、CMGを中心にDNA複製の研究を進めており、Ctf18–RFCがリーディング鎖ポリメラーゼであるPol εと協調して機能する事などを発見しています。
 DNAの複製は、信じられないほど高い正確性を要求されるプロセスです。たとえば二倍体ヒト細胞のゲノムは約60億塩基対もあり、一千万合成に一回というきわめて低レベルの間違いでも、ゲノムあたりにすると一回のコピーで1000個近い間違いを産むことになります。細胞はどのようにしてDNA複製の正確性を担保しているのでしょう。
DNAの複製は、信じられないほど高い正確性を要求されるプロセスです。たとえば二倍体ヒト細胞のゲノムは約60億塩基対もあり、一千万合成に一回というきわめて低レベルの間違いでも、ゲノムあたりにすると一回のコピーで1000個近い間違いを産むことになります。細胞はどのようにしてDNA複製の正確性を担保しているのでしょう。
DNA複製の正確性は、DNA合成酵素自身の持つ驚異的な正確性に加え、DNA合成の誤りを修復するミスマッチ修復システムによって維持されています。ヒトにおいてミスマッチ修復が全く機能しない場合、わずか一年から数年で多数のがんを発症することからも、この修復システムがいかに大事な働きをしているかが分かります。当研究室では、ミスマッチ修復がどのようにして修復すべき塩基を同定しているか、それがクロマチン上で機能するためにどのような因子が必要か、などを研究しています。
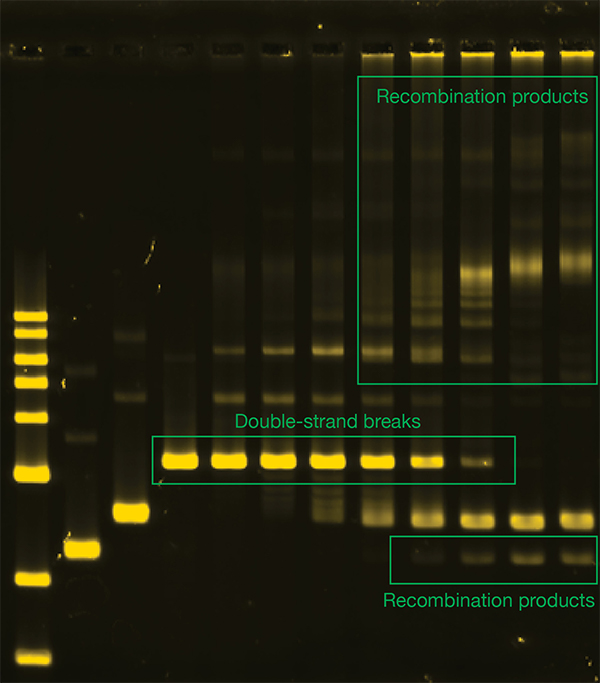 ゲノムDNAが放射線や反応性の高い化学物質などによって損傷を受けると、DNAの鎖が切断され、染色体が切れてしまうことがあります。このような損傷をDNA二重鎖切断損傷と呼びます。DNA二重鎖切断はきわめて深刻な損傷で、たった一カ所でもこれが残ると染色体が維持できず、ゲノムの部分的喪失や細胞死に直結します。細胞はDNA二重鎖切断損傷を修復する様々な機構を持っており、そのうちの重要な一つが相同組換えです。相同組換えは損傷を受けていないDNAを鋳型として情報をコピーすることで、損傷部位を正確につなぐことができる、大事な修復反応です。
ゲノムDNAが放射線や反応性の高い化学物質などによって損傷を受けると、DNAの鎖が切断され、染色体が切れてしまうことがあります。このような損傷をDNA二重鎖切断損傷と呼びます。DNA二重鎖切断はきわめて深刻な損傷で、たった一カ所でもこれが残ると染色体が維持できず、ゲノムの部分的喪失や細胞死に直結します。細胞はDNA二重鎖切断損傷を修復する様々な機構を持っており、そのうちの重要な一つが相同組換えです。相同組換えは損傷を受けていないDNAを鋳型として情報をコピーすることで、損傷部位を正確につなぐことができる、大事な修復反応です。
相同組換えは非常に不思議な損傷修復経路で、組換え酵素の働きによって相同配列を探し出し、その情報を利用します。ところが、ゲノム上には類似するけれど完全に同じではない、よく似た配列がたくさんあります。さらに、組換え酵素だけではこれらの類似配列を十分に区別できないことが分かっています。では、類似配列の間で誤った組換えは起こらないのでしょうか。
類似するけれど同じではない配列間で組換えが開始されると、配列が違う場所ではうまく対合できない塩基が生じます。面白いことに、ミスマッチ修復システムはこれらの対合できない塩基を探し出し、そういった塩基を生じるような誤った組換えを中止させます。当研究室ではこの反応を試験管内で再現し、どのような分子メカニズムで誤った組換えの中止が起こるのかを解析しています。
 DNA損傷が生じると、細胞はそれを感知して修復システムを動作させ、また細胞の増殖を一時停止させる必要があります。そうでないと、修復が終わる前に細胞分裂が起こってしまい、染色体の情報が失われてしまいます。この機構はDNA損傷チェックポイントと呼ばれます。
DNA損傷が生じると、細胞はそれを感知して修復システムを動作させ、また細胞の増殖を一時停止させる必要があります。そうでないと、修復が終わる前に細胞分裂が起こってしまい、染色体の情報が失われてしまいます。この機構はDNA損傷チェックポイントと呼ばれます。
DNA損傷チェックポイントにはさまざまな因子が関わっていますが、実はクランプローダーの一種であるRad17–RFCも重要な働きをしています。このクランプローダーは、PCNAではなく、9–1–1(Rad9–Rad1–Hus1)と呼ばれる、PCNAに類似したクランプをDNAに乗せます。Rad17–RFCと9–1–1は損傷の検知とチェックポイント活性化に機能する損傷センサーですが、その反応メカニズムにはまだ分からない点がたくさんあります。たとえば、9–1–1にはPCNAにはない天然変性領域(C-tail)があり、この領域がチェックポイント活性化に必須なのですが、この領域の制御は複雑で、十分に理解されているとは言えません。さらに、9–1–1がDNAのどのような構造に結合しているかすら、よく分かっていないのです。当研究室では、9–1–1複合体を精製しその生化学的な活性を調べたり、9–1–1のさまざまな変異体を作成したりすることで、ヒト細胞における9–1–1の機能を解析しています。
 遺伝情報の複製、維持機構を解析するには、それらの反応を試験管内で再構成し、反応のメカニズムを探ることが非常に有効です。試験管内再構成によって、ある反応に最低限必要な因子が分かりますし、それらの変異体を使って反応メカニズムを調べることもできます。当研究室ではDNA複製の伸長反応(DNA/CMG/Pol ε/Ctf18–RFC)や、複製クランプのローディング(DNA/PCNA/RFC)、アンローディング(DNA/PCNA/RFC/Elg1–RFC)、チェックポイントクランプのローディング(DNA/9–1–1/Rad17–RFC)、クロマチン上でのミスマッチ修復の初期反応(Nucleosome/MutSα/Smarcad1)など、さまざまな反応を試験管内で再構成して研究しています。
遺伝情報の複製、維持機構を解析するには、それらの反応を試験管内で再構成し、反応のメカニズムを探ることが非常に有効です。試験管内再構成によって、ある反応に最低限必要な因子が分かりますし、それらの変異体を使って反応メカニズムを調べることもできます。当研究室ではDNA複製の伸長反応(DNA/CMG/Pol ε/Ctf18–RFC)や、複製クランプのローディング(DNA/PCNA/RFC)、アンローディング(DNA/PCNA/RFC/Elg1–RFC)、チェックポイントクランプのローディング(DNA/9–1–1/Rad17–RFC)、クロマチン上でのミスマッチ修復の初期反応(Nucleosome/MutSα/Smarcad1)など、さまざまな反応を試験管内で再構成して研究しています。
 生化学的再構成は強力な研究手法ですが、必要な全ての因子が揃っていないと反応を再現できません。一方で、細胞の粗抽出液には全ての因子が含まれているので、これを有効利用することでさまざまな反応を試験管内で再現できます。
生化学的再構成は強力な研究手法ですが、必要な全ての因子が揃っていないと反応を再現できません。一方で、細胞の粗抽出液には全ての因子が含まれているので、これを有効利用することでさまざまな反応を試験管内で再現できます。
ツメガエルの初期発生においては、卵の体積は増えず、卵割によって細胞数だけが増えていきます。このとき、染色体は必ず複製、分配が必要ですが、一回の卵割にかかる時間はわずか20分ほどで、この短い時間内に染色体の複製と分配を終えなければなりません。卵には、こうした急速な染色体の複製、分配に必要なタンパク質群があらかじめ大量に蓄えられています。これをほとんど薄めずに取り出すことで、染色体の複製、分配、修復など、さまざまな核内反応を試験管内で引き起こすことができます。
当研究室では、卵の粗抽出液からさらに核質タンパク質を高濃度に取りだした抽出液(NPE)を利用しています。NPEは間期の核内環境を試験管内で再現することのできる抽出液で、いわば「試験管の中の細胞核」と言えます。これを利用することによって、精製タンパク質だけでは再現の難しい、クロマチン上でのミスマッチ修復や、クロマチンの複製、DNA複製と染色体分配のカップリング反応など、複雑な染色体反応を試験管の中で再現することができます。